TauroLock® tünelli ve tünelsiz damar kateterleri veya port sistemlerinde tedavi aralarında dahili akış sistemini olumsuz etkileyecek bakteriyel veya fungal biyofilm oluşumlarını önleyici kateter kilit solüsyonudur.
ANTİBİKROBİYAL ETKİNLİK
Kataterle ilgili kan basıncı enfeksiyonlarına karşı korunma:
Merkezi venöz kataterler (CVC) hemodiyaliz, onkoloji, ICU ve toplam parenteral beslenmede kısa veya uzun vadeli vasküler giriş kataterlerde kullanılır. CVC işlevsizliği için büyük riskler, kataterle ilişkili enfeksiyonlardır (CRI). Bu enfeksiyonlar kataterin mikrobiyal kolonizasyonu ile tetiklenebilir ve mikroorganizmalar buradan kan akışına yayılabilir. CRI, kataterin anında çıkartılmasını gerektiren septik semptomlar geliştirebilir.
TauroLockTM kateter kilit solüsyonları, antibiyotik içermez ve hastalıktan korunma amaçlı geliştirilmiştir.
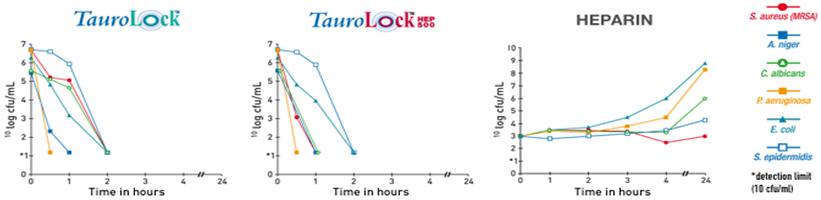
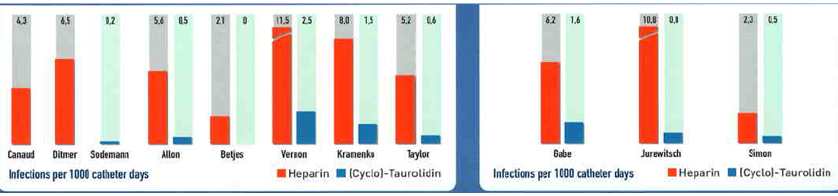
Cyclo-Taurolidine ; Kateterle ilgili enfeksiyonları önemli ölçüde azaltırlar (~%90)
Sitrat (%4) (cyclo)-taurolidine’li ve heparin/ürokinazın birleşiminin de ,MRSA ve VRE gibi dayanıklı mikroorganizmalara karşı mükemmel önlem alan ,bir pıhtılaşma önleyici ve anti-mikrobiyal özelliklere sahiptir.
Bu sebeple, TauroLockTM Alman Diyaliz Standartlarını tamamlayan Hijyen Yönergeleri, Pediyatrik Onkoloji ve Hematoloji Alman Topluluğu’nun (GPOH) kanıtlanmış tavsiyeleri ve Bonn Üniversitesi (Almanya)’nın hijyen yönergeleri gibi farklı yönergelerde (bakınız ref. A) tavsiye edilmiştir.
Taurolock Ürünleri:
- TAUROLOCK (HEPARİN İÇERMEYEN ÖZELLİK) KAT NO: TP-01
- TAUROLOCK HEP 100 (100 UNİT HEPARİN İÇERİR) KAT NO: TP-03
- TAUROLOCK HEP 500 (500 UNİT HEPARİN İÇERİR) KAT NO: TP-02
- TAUROLOCK 25.000 UNIT ÜROKİNAZ KAT NO: TP-05

FDA Tricitrasolile ilgili uyarılarda bulunuyor. Amerikan gıda ve ilaç yönetimi (FDA) bütün hastane eczanelere hemodiyaliz birimlerine Tricitrasol’un kan yolların açık tutulması amacı kullanımı hasta ölümlerine neden olabilecegi konusunda uyarılarda bulunmaktadır. Tricitrasol 30ml. cam şişeviyolde aynı olarak veya aksesuarları ile birlikte hemodiyaliz kiti olarak satılmaktadır. FDA yakın zaman önce bir hastanın tedavisinde kullanılan 46.7% sodyum sitrat ihtiva eden Tricitrasol enjeksiyonun dan sonra, kalp krizinden ölmüştür. Hızlı ve aşırı sitrat solusyon enjeksiyonu kan kalsiyum kaybına neden olduğundan kalp ritim bozukluğuna neden olabilir ve hatta ölüme sebebiyet verebilir.Tricitrasol’dan kaynaklandığına inanılan diğer bazı vakalarda halen FDA incelemesindedir. Tricitrasol Cytosol Laboratories Braintree.Mass.Firması tarafından üretilmekte ve önceleri Citra Anticoagulantsinc.Simdilerde Medcomp HarleysvillePa. şirketleri tarafından pazarlanmaktadır. Ürün iki şirket tarafından gönüllü olarak piyasadan geri çekilmiştir. FDA ülke çapına hastane eczanelerin ve hemodiyaliz ünitelerine ürünlerin kullanımını durdurmaları konusunda ikaz etmiştir. Alternatif olarak 4% sitrat solusyonları bütün ilgili marketlerde mevcuttur ve kullanımı önerilmektedir. Kantransfüzyonu için gerekli olan akyuvar hazırlığında gerekli bir madde oldugu için FDA ve Firmadilusyon için gereken malzemeyi gözetim altına almıştır. Nisan 2000 yılında Medcomp müşterilerine bir mektup göndererek Tricitrasolitiva eden kitleri ve MedcompAsh Split kateteri, hemodiyaliz, kan ayrıştırma, yeniden transfuzyon kateterlerini geri çağırmıştır. Ülke çapında 3000 Medcomp kiti dağıtılmıştır. Ayrıca Kanada ve Puerto Rico’da dağıtım yapılmıştır. Vakalarla ilgili daha geniş bilgi için Medwatch1-800-FDA-1088 telefonu ile kontak kurabilirsiniz veya email info@nmw9.esrd.net
